法规依据
《中华人民共和国行政许可法》、《医疗器械监督管理条例》(国务院令第680号)第八条、第九条、第十一条、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第十三条、第十四条。
适用条件范围
1. 境外生产企业为注册申请人,以及产品责任主体;
2. 该医疗器械在申请人或者生产企业所在国(地区)已获准上市销售;
3. 境外企业需要在中国境内设有代表机构或者指定中国境内的企业作为代理人。
注册批件的有效期
从发证之日起,有效期为5年,到期前6个月申请延续。
注册办理周期
从提交注册资料开始大约1-2年,具体根据产品不同以及申请人的实际情况而有别。
(如需临床试验,则周期延长0.5—2年0不等)
注册需要提供的关键资料清单
1. 境外注册人企业资格证明文件;
2. 产品注册证/许可凭证;
3. 生产厂家的体系证书;
4. 生产厂家的产品销售证明;
5. 指定代理人的委托书;
6. 产品技术要求一致性声明;
7.产品技术报告;
8. 临床试验资料(如是国外的临床数据,需要提供临床试验方案、伦理意见、临床试验报告(包含对完整临床试验数据的分析及结论);——如产品在国内属于免临床类别,则不需要临床报告,可提供等同对比。
9. 产品说明书及标签样稿;
10. 产品质量保证声明;
11. 在中国指定售后服务机构的委托书;
12.产品中文名称使用声明;
13.产品注册检验报告;
14.代理人的设备清单(主要是仓储、运营、检验所需);
15. 指定中国境内售后服务机构承诺书及其资格证明。
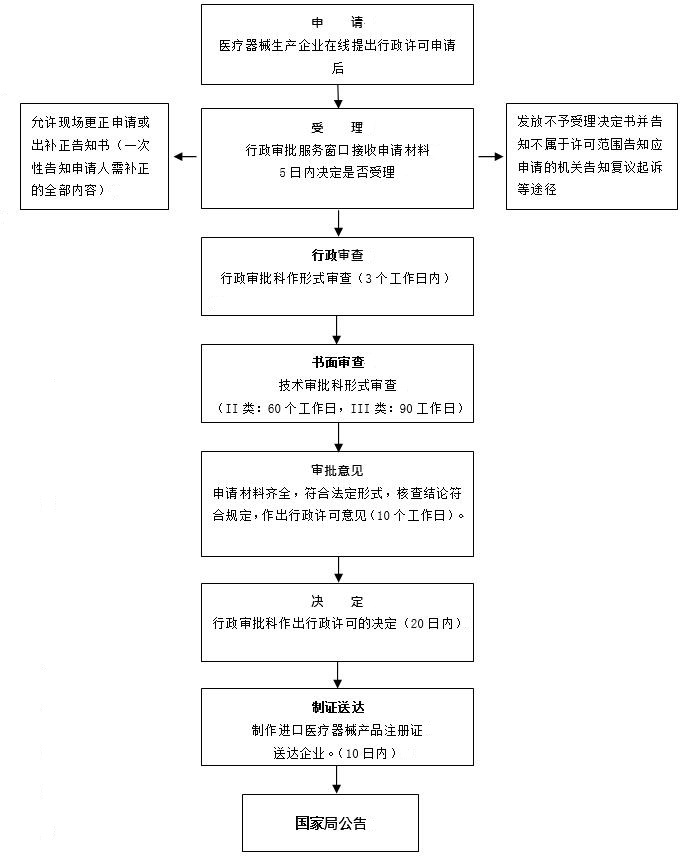
审批流程图示
这家伙很懒,还没有设置简介