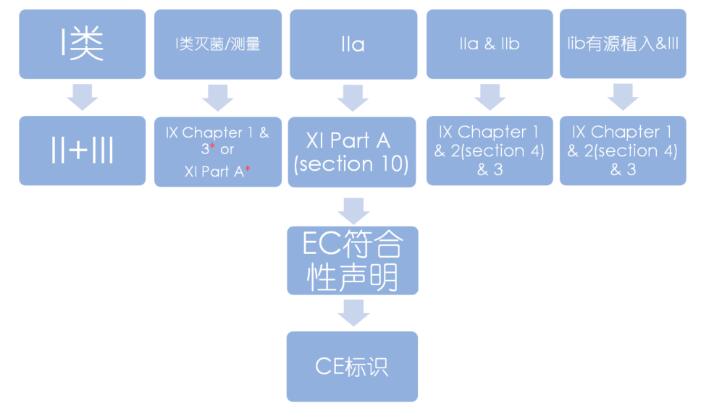
1 回答
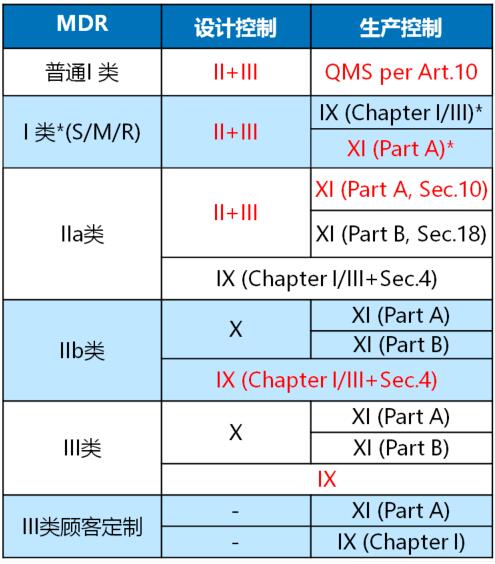
说明
附录IX QMS+技术文件
- Chapter I: 质量管理体系
- Chapter II: 技术文件评审
- Chapter III: 行政规定
附录X 型式检查
附录XI 产品符合性验证
- Part A: 生产质量保证体系
- Part B: 产品验证
*) 针对MDR的I类灭菌、测量或重复使用产品,公告机构仅关注和保持无菌条件、计量要求和重复使用有关的内容。
-----------------------------------------
附录II 技术文件
附录III 有关上市后监督的技术文件
MDR常用路径图解