经验分享|临床试验方案设计
1、法规要求:25号令、临床试验设计指导原则等
2、产品分析:
(1)试验器械的定位
首研性(创新产品)单组目标值法
替代对照产品(疗效优于对照产品)优效性设计
并存或仿制(疗效与对照产品类似) 等效设计或非劣效设计
适用范围:适应症是否便于包含在同一个方案设计中
对照产品的选择:与对照产品相同或类似?业界公认的手段或方法? 综合性诊断方法?适用范围相同,产品可获得,证书有效。
产品的临床策略:前瞻性研究、回顾性研究
3、评价指标
主要指标:与试验目的有本质联系的,能确切反映器械有效性和安 全性的观察指标。
与试验目的相关的辅助性指标。
替代指标:直接测量临床效果不可能时,用于间接反映临床效果的 观察指标。
要求:易于观察、易于量化、客观性强、重复性高
4、比较类型(按假设检验分)
优效性检验:假设试验组比对照组疗效好
等效性检验:假设试验组与对照组疗效相当
非劣效检验:假设试验组疗效不比对照组疗效差,或者试验组疗效 比对照组疗效差,但差值小于非劣效界值。
5、对照方式的选择:目的是通过对比降低或消除混杂因素对结果的影响。
阳性对照:采用已知的公认的有效治疗作为对照。
安慰剂对照:不含有治疗成分,目的在于克服研究者、受试者等由于 心理因素而产生的数据偏倚,安慰剂必须在盲态作用下使用。
空白对照:不给予治疗。
目标值对照:与金标准进行对照。
6、设计的类型
(1)平行设计:受试者随机分到不同的治疗组,常见的是分别分配到试验 组或对照组。

优点:个体治疗效果确定
缺点:非处理因素多,容易组间不均衡,样本量大
(2)交叉设计:受试者既接受试验组的治疗又接受对照组的治疗。
第一阶段 洗脱期 第二阶段
优点:样本量比平行设计少一半
缺点:洗脱期难以确定,两阶段病情变化造成疗效难以评估
8、偏倚的控制
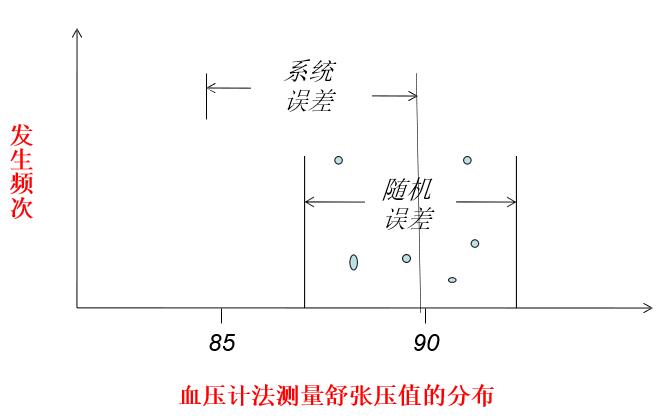
误差:测量值偏离真实值的部分,包括随机误差、系统误差,其中系统误 差称为偏倚。
举例:血压计测量 某人血压(实际值 85mmHg),各次 测量的均值为 90mmHg。
8、偏倚的控制
随机误差:不可避免、具有规律性,重复是控制和缩小随机误差的主要方法。
系统误差(偏倚):选择偏倚、信息偏倚、混杂偏倚,应加以控制甚至消除,但加 大样本量无法减少此类误差。
(1)选择偏倚
产生的原因:抽样未严格遵循随机化原则
控制方法:盲法、随机化。
(2)信息偏倚
定义:由于测量、诊断、询问或抄录过程中收集资料不当,使观察对象的某些特征 被错误分类而产生的误差。
产生的原因:信息收集方式不当、患者提供的信息准确性不足、评价者经验不同。
控制方法:试验组和对照组信息收集方法要一致,测量手段一致,客观的疗效评价 指标。
8、偏倚的控制
(3)混杂偏倚
一个或多个外来因素的影响掩盖或夸大了试验器械与终点事件之间的联系。 举例:输液器

此例不良事件是否与试验器械有关?
感冒药临床试验如何评价药物疗效?
8、偏倚的控制
(3)混杂偏倚
控制方法:识别混杂因子,在筛选阶段进行排除;收集可以确定混杂因子的相关资 料,根据专业知识和经验排除混杂因子的干扰;随机化(按照混杂因子进行分层)。
随机化:为了在选取样本和将受试者分组时,防止来自研究者与受试者两个方面 的主观因素干扰,避免结果偏离真实值——避免选择偏倚。
对照:为了消除混杂因子的干扰——避免混杂偏倚。
盲法:为了克服可能来自研究者或受试者的主观因素所导致的偏倚——避免信息 偏倚。
重复:为了降低抽样误差,显示研究总体真实的客观规律——样本量。
9、样本量的计算
非劣效界值(Δ)的大小。以“XXX”、“XXX”“疗效”为关键词,查阅国内外文献, 尤其关注随机对照临床试验数据,得到输注类产品非劣效界值设计一般为10%~20%,最 终试验结果显示两组疗效基本无差异。鉴于临床专家和统计学家的建议,本试验非劣效界 值取10%;
两组的使用有效率大小。根据临床文献和本公司前期临床试验有效率的结果,本次试 验试验组有效率(P1)估计为96%,对照组(P2)估计为96%;
单侧或双侧。本次试验采用单侧检验;
显著性检验水准(α)。本次试验定为单侧0.025;
统计把握度(1-β)大小。本次试验为90%。 利用非劣效检验样本量计算公式(平行设计):
其中P=(P1+P2)/2,由此估算得到样本量约为162例。考虑到试验过程中15%的病例脱 落,试验纳入病例数应不少于191例。考虑到三中心纳入病例数平均分配,试验组和对照 组平均分配,病例扩充10%,最后确定本次试验样本量为216例。本次试验在3家中心同时 开展,每家医院承担72例,试验组与对照组各36例。
10、受试者的选择
入选标准:受试者必须满足以下所有要求。
排除标准:其中符合以下任意一条要求的,不能入选。
脱落标准:所有填写了知情同意书并且筛选合格入选的受试者,无论何时 何因退出临床研究,只要没有完成方案所规定的所有观察项目,均为脱落病例。
剔除标准:不符合入/排标准的病例,随机后未使用试验器械的病例。
11、伦理学考虑
给受试者带来的风险、受益和不便。
医疗服务、补偿、保险和赔偿。
拒绝后是否会带来偏见治疗。
隐私保护,对于可以识别受试者身份的信息,例如身份证号、姓名、敏感 疾病等需要进行安全编码。

全部 0条评论