质量体系审核:确定质量体系的活动和结果是否符合标准的安排以及质量体系的各项规定是否得到有效的贯彻并适合于达到质量目标的、系统的、独立的检查。
A 符合性:对质量体系文件(质量手册、程序文件)是否符合标准要求。
B 有效性:质量体系活动与文件要求是否一致,即文件要求是否有效实施。
C 适宜性:质量体系的实施结果是否适合达到质量目标的要求。
D 系统性:审核工作本身要求正规化,有程序可以遵循。
E 独立性:审核应由与被审对象无直接责任关系的人员进行。
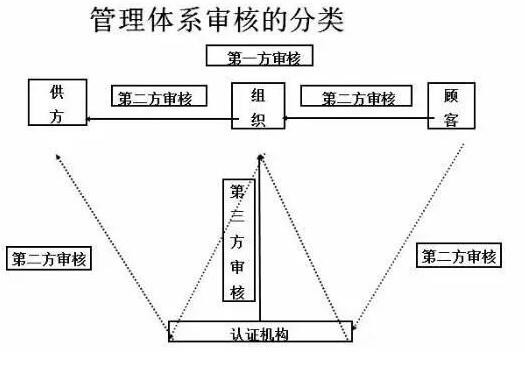
质量体系审核的分类
第一方审核:一个企业对其自身的质量体系所进行的审核。
第二方审核:需方派出审核员按合同规定的要求对它的供方的质量体系进行审核。
第三方审核:公正的第三方对申请的企业进行的独立的质量体系审核。