知识分享|EMA药品、活性物质、辅料和内包装灭菌指南翻译与解读(一)
6 March 2019

本指南替代“药物研发指南”(CPMP/QWP/155/96)的附件文件“灭菌方法选择决策树”(CPMP/QWP/054/98)和“兽药研发指南”(EMEA/CVMP/315/98)的附件文件“灭菌方法选择决策树”(EMEA/CVMP/065/99)
Table of contents 目录
1. Introduction (background)概述(背景)
2. Scope 范围
3. Legal basis 法律依据
4. General requirements一般性要求
4.1. Requirements for the manufacture of sterile medicinal products and sterile components 无菌医药产品和无菌组件的生产制造要求
4.1.1. Steam sterilisation 蒸汽灭菌
4.1.2. Dry heat sterilisation 干热灭菌
4.1.3. Ionization radiation sterilisation 放射灭菌
4.1.4. Gas sterilisation 气体消毒灭菌
4.1.5. Sterile filtration 除菌过滤
4.1.6. Aseptic processing 无菌工艺
4.2. Good manufacturing practice for sterile active substances, sterile excipients and sterile containers 无菌原料药、无菌辅料和无菌包材的GMP要求
4.2.1. Active substances 原料药
4.2.2. Excipients 辅料
4.2.3. Containers 包材
4.3. Selection of sterilisation method 灭菌方法的选择
5. Decision trees 决策树
6. Definitions 术语表
7. References 参考文献
Executive summary
实施摘要
Guidance is provided on the selection of appropriate methods of sterilisation for sterile products. Although, terminal sterilisation using a reference condition of the European Pharmacopoeia (Ph. Eur.) is the method of choice whenever possible, this guideline provides information on when other terminal sterilisation processes, sterilising filtration or aseptic processing, (either alone or when combined with an additional post-aseptic processing terminal heat treatment), could be accepted as an alternative.
本指南提供无菌药品灭菌方法的选择。尽管使用参考EP条件进行终端灭菌是优先选择的方法,本指南提供了当其它终端灭菌工艺、除菌过滤或无菌工艺(单独或与无菌工艺后加终端热处理工艺联合使用)可以被接受作为替代方法时的信息。
Guidance is provided on the documentation expected for sterile finished products, sterile active substances, sterile excipients and sterile primary containers (referred to as container in this guideline) in a new marketing authorisation application or a variation application for a medicinal product, (called quality dossier throughout the guideline).
本指南提供了关于新的无菌产品上市许可申报或无菌产品变更申报(本指南中称为“质量文档”)中的关于对无菌制剂产品,无菌原料药,无菌辅料和无菌内包材(本指南中称为“包装”)的文档预期。
Terminology definitions are included at the end of the document.
相关术语的定义参考本指南末端的说明
1. Introduction (background)
概述(背景)
无菌是所有无菌原料药、药品和包材的关键质量属性。药品的无菌不能通过测试来保证,它需要由使用适当设计的、经过验证的且受控的生产工艺来确保。无菌控制可以通过多个因素来实现,例如生物负荷、灭菌程序、容器密闭系统的完整性、对于无菌工艺,则是取决于满意的无菌技术的应用。
终端灭菌永远优先于除菌过滤和/或无菌工艺,因为它能消灭微生物且可以提供可以计算、验证和控制的更加可靠的无菌保证水平(SAL),从而构建了安全边际。对于采用除菌过滤后,进行的无菌工艺来说,由于技术不充分而导致的偶然污染使得其SAL不完全可靠,因为这些污染无法通过监测或控制可靠地清除。所以终端灭菌可以带来较高水平的无菌保证,必须始终优先考虑。
对于高度热敏感的产品,例如生物药品,如果药品无法进行终端灭菌,在受控和验证条件下的除菌过滤和/或无菌工艺是可以被接受的。
除菌过滤和无菌工艺是高度相关很难区分的,因为除菌过滤在大多数情况下都会涉及到至少一种无菌工艺步骤,例如无菌灌装。本指南为了集中关注最重要的除菌过滤和无菌工艺,可能仅仅会提到其中的一项技术,即使两者实际是关联的。
另外,对于那些配方本身使得终端灭菌无法进行的那些药品(即使配方本身可以进行最终灭菌,如果患者或药品用户可以从无菌工艺中获得其它好处),使用无菌工艺在特定的情形下也是可以接受的。这些情形在以下第4.3部分描述。
容器完整性在ICH Q8里进行了讨论(正式采纳仅适用于人用药品,但是相同的原则还是适用于兽药)。
2. Scope
范围
本指南适用于人药和兽药的化学和生物制剂,但不适用于兽用免疫制品。
本指南中提供的建议可能需要对“人用先进治疗药物”(ATMPs)的特定特性进行一些调整(例如,在某些情况下难以区分起始物料、活性物质和成品、起始物料/活性物质/成品相对稀缺【自体产品和匹配供体方案】,小批量生产)。如果根据基于风险评估证明这是合理的,则可以在ATMPS上市申请中的调整所需的文档级别。对于基于兽医细胞的新疗法,交叉参考EMA/CVMP/Advent/751229/2016的“关于兽用同种干细胞产品的问答:关于无菌的具体问题”。
本指南提供了灭菌方法的选择,在进行合适的无菌工艺选择的时候必须考虑具体产品的研发数据和生产数据。对于无菌原料药、辅料和内包材,相同的原则(选择灭菌方法、研发数据和生产数据)也一样适用。本指南只描述了对质量文档中所需的信息,包括关于GMP证书需求信息,不包括通用的GMP要求(比如环境监控,生产设备的灭菌等)。
The scope of this document includes:
本指南的范围包括:
采用EP5.1.1“无菌产品的制备方法”或其他药典给定的条件,采用蒸汽、干热和放射源进行的终端灭菌的方法
除菌过滤和无菌工艺方法
使用气体进行消毒灭菌的方法
在本指南中的概念仅指细菌、霉菌和细菌内毒素的清除情形。病毒、支原体、朊病毒和其它外来可能污染药品的试剂的消除、清除或灭活不在本指南范围。对于病毒验证请参考CPMP/BWP/268/95 “病毒验证指南:病毒灭活和清除验证的设计、实现和阐述”
【解读】
概述很实在,反复强调了终端灭菌的地位以及其背后的科学逻辑。只有终端灭菌是真的杀灭了微生物,并且其杀灭的效果可以进行客观的控制和检测出来。其他任何的无菌工艺技术因为存在技术上的天生局限性,无法对微生物进行杀灭,无法对微生物的最终状态进行定量客观的控制以及明确的检测,所以都存在一定的理论和实际上的交叉污染的风险。任何法规背后都必须是科学基础,这点在这里体现的很好!
特殊制剂类型,特殊产品,特殊包材性质决定了不可能在实际操作中都使用终端灭菌,所以才有了本指南的讨论,也才有了无菌工艺这个说法,也才有了GMP上最难监管、控制和测试的一个领域,这个领域不可避免的引入了人这个最大的可变要素,所以我们才说在整个GMP监管上无菌工艺的难度是最难的,也是最有挑战的。
回到现实,本指南的适用范围在本章节也进行了框定。基本符合我们最熟悉的无菌和灭菌过程,没有更多进行讨论的余地。
3. Legal basis
法规依据
本指南应与欧盟人用药指令2001/83/EC和欧盟兽药指令2001/82/EC及其修订内容以及现行EP一起解读。
此外,本指南应与所有其它相关指令和法规,以及所有相关委员会、(V)ICH和CXMP指南、问答文件及其它相关文件或EMA网站(w w w. ema.europa . eu)公布的文件一起解读。
4. General requirements
一般性要求
本指南只是针对无菌产品和产品组分的无菌,灭菌工艺和无菌工艺的特定要求。对于药品生产中的其它要求,参见其它指南如制剂生产指南。
4.1.
无菌药品和无菌组件的生产制造要求
灭菌方法或无菌工艺的选择应进行合理化解释,参见第4.3部分灭菌方法的选择。
所有灭菌工艺过程应根据EP要求实施,除非另有合理理由。
【解读】
“Justification”是典型的欧美用语,也是和中国监管当局目前的评审态度最大的区别所在。当然,我们目前自己的业内企业也不具备“合理科学解释”的综合能力。这里需要进行解释的是两个要点:为啥要选择某个灭菌/无菌工艺?某个灭菌/无菌工艺的实施细节是否和EP规定一致,如果不一致,为什么允许其不一致?
大部分有过实际欧美注册经验的朋友,都知道在进行这类问题的阐述的时候,最好的理由不是“引经据典”,最好的理由是采用科学实验的直接的监测数据(“摆事实、列数据”)。
所有制剂成品、原料药、辅料或内包材的灭菌程序应进行描述,还必须注明负责灭菌的工厂名称和地址。应按以下所述要求提供每个灭菌工艺的灭菌方法和/或无菌工艺方法,包括中控和验证数据。
【解读】
在目前的市场环境下,大量的无菌操作开始被专业化的机构和公司分包,比如包材有专业的公司进行灭菌处理,比如某些特殊的灭菌工艺(例如辐射灭菌)委托给专业的机构进行操作,那么这些机构的相关信息、工艺数据、以及相关的质量协议和审计报告就不能缺席了。在实际操作中,这类委托机构,因为服务大量的不同客户,其标准往往是相对统一的,对于存在特殊要求的企业,需要在质量协议和现场监管上下功夫,确保自己的特殊要求被满足。另外,也要高度重视这类机构的合规风险,如果其客户群中存在不规范的行为,药监当局会采取措施封杀整个委托机构,那么自己的产品也会被“误伤”。
如果采用无菌参数放行,应考虑实施“实时放行测试指南”(之前的“参数放行指南”) EMA/CHMP/QWP/811210 /2009-Rev1 (仅人药)和“参数放行指南”EMEA/CVMP/QWP/ 339588/2005 (仅兽药)以及EP第5.1.1章文本。
所有灭菌工艺之前的生物负荷控制标准必须明确。设定高生物负荷限度标准不应使用灭菌工艺的能力,或任何灭菌之前生物负荷减除步骤来进行论证。生物负荷的可接受标准在4.1章节相关部分进行讨论。
【解读】
这个思路是值得我们高度重视的,简单的理论论证不能取代实际的标准和检测结果数据,生物负荷是非常关键的指标,对于无菌工艺而言,也意味着实际风险的大小,所以不要用“评估”的方法来取代实际的测试,一句话,还是用数据说话比较靠谱。
制剂成品组分(活性物质、辅料和内包材)中的生物负荷和细菌内毒素水平,以及那些在生产过程中引入的微生物污染都可能会对制剂成品细菌内毒素水平产生影响。为了确保制剂成品中的细菌内毒素水平可以接受,制剂组分中的微生物水平应尽可能降低。如果有关联,应提供制剂组分和散装溶液中内毒素和生物负荷的质量标准限度。
【解读】
对于大部分的企业来说,目前都知道要有相关的内毒素和生物负荷的标准限度,但是关键是这个标准如何设置,是否简单的符合USP的通则要求就可以接受?在这里,良好的商业合作流程,这个标准应该是制剂客户给自己的上游企业提出来,因为只有制剂客户自己知道自己后续有哪些工艺,最差的内毒素和生物负荷是自己可以承受的。而对于那些计划做欧美市场的原料药企业来说,如果自己的注册部门或是技术部门有能力知道后续制剂产品的规格,制剂的通用工艺水平,那么主动的提出自己的“绝对安全”的标准,绝对是加分项。对于包材辅料企业比较复杂,因为大量的包材辅料的质量人员对于制剂客户的“限度要求”实际不具备这样的知识,也不愿意花时间去了解这些信息要求,所以对制剂客户的采购来说,这是一个工作挑战了,对于制剂客户的QA来说,现场审计辅料和包材供应商的时候,供应商现场的内毒素和生物负荷控制能力、手段以及检测能力变成一个很重要的点。
在制剂生产过程中所有和成品以及制剂组分(活性物质或中间体)接触的过滤器都必须进行描述,这些信息必须在质量文档的4.1.5章节的表格3进行阐述。相关信息必须符合Eudralex GMP附录1的要求。对于ATMPs产品,还必须遵守ATMPs产品优良制造指南。
【解读】
和物料接触的过滤器,用的好,是无菌工艺有效的保证;用的不合适或是用的不好,则是一个潜在的微生物污染源。这个绝对是辩证统一的一对矛盾,国内企业在产品价格敏感的背景下,往往对过滤器的实际使用、清洗、消毒、维护保样以及选型都会不同程度的忽略质量角度的考量。我们有机会会组织关于无菌过滤器相关指南和文献的讨论和解读,在这里就先行忽略了。
如果使用了外包容器(例如,输液袋的外袋,或者是为了保护内包装无菌性外表而使用的泡罩)来为药品提供特定保护,则应描述包装工艺,包括风险评估,因为这可能会影响最终产品的无菌性,比如在内包装和第二层包装之间形成湿汽。应要提交信息说明什么时候进行包装(灭菌之前还是之后)以及采用的是什么无菌技术。所采用的工艺应从微生物角度进行合理化解释。如果使用外包装意味着要对药品进行额外灭菌,则要对额外灭菌的无菌性保证能力进行解释,以及评估对药品质量的所有可能影响。
灭菌和无菌工艺相关的文件归档在质量文档的以下章节:这些文件和3.2.P.3.3或第2 B部分列出的需要灭菌处理的组分相关联。具体文档归档在人用药质量文档的模块三第3.2.S.2原料药生产、第3.2.P.2药物研发、第3.2.P.3制剂生产、第3.2.P.4辅料控制或第3.2.P.7密封包装系统中的灭菌和无菌工艺文件,或者是兽药质量文档Part 2 A.4药物研发、Part 2 B.1生产方法描述、Part 2 C.1 原料药、Part 2 C.2 辅料或Part 2 C.3 密封包装系统. 要提供实施药品灭菌或无菌工艺的所有场所或无菌工艺相关的文件,不管是在公司内部还是外包给合同制造设施进行。
工艺时间和保存时间之类的工艺参数需要在质量文件评价过程中进行评估和达成共识。这些也会在后续的GMP检查中进一步被审核确认,这也可能会导致相关注册文件的变更。
4.1.1. Steam Sterilisation
蒸汽灭菌
所有蒸汽灭菌工艺都要求F0≥ 8分钟,以及最低工艺保温温度为110 °C。
【解读】
这个就是底线要求。F0值/F值要搞清楚,就不得不了解D值,Z值,本篇没有篇幅去解释这些参数的实际含义和科学道理,只能简单粗暴的假设我们的读者是能理解这些参数的含义的。但是关于最低温度设定在110°C,是很有意思的一个设定。理论上,我们没有任何科学的理由来支持这个温度点的设定。考虑到F0值的限度要求,保温温度越接近121°C,就越可以在尽可能短的时间内实现这个目标。所以这个最低温度是越高越好的,但是随着温度的增高,实际压力也是需要增加的,理论上110°C的蒸汽压力就是1.43个大气压了,而121°C的蒸汽压力就是2.05个大气压了。而且在这个温度下计算F0值是最简单的,保温110°C八分钟,算出来的F0值也正好是8,符合F0值的最底线要求。可能正是综合考虑了安全性和时间效率两个角度,欧盟官方最后选择了这个110°C的最低温度点。
不同致死率的灭菌工艺参见表格1,也包括需要在质量文档涵盖的文档内容。表格中的工艺从上到下罗列了逐渐降低的致死能力,所以优选选择第一个可行的工艺参数。
对于使用EP5.1.1参考条件(所有包装均≥121°C, ≥15 min)的灭菌,不需要在质量文档中提交灭菌循环的验证数据。
【解读】
这个其实是最优选择,优越到你都不需要递交数据给官方了!因为在这个条件下,即便不做任何的计算,你也直接可以发现这个条件是之前F0值=8的要求的接近两倍了,是属于典型的过度灭菌了,那么还有啥好说的了?
如果使用额外控制手段对工艺灭菌能力的进行监测, 则应说明该方法的F0值, 以及由温度探头测得的最低温度来确定F0值。
成品温度低于115°C保持一定时间的蒸汽灭菌是一种特殊情况, 应进行科学论证, 并有表格1所述的其他数据的支持。如果在确定F0值的数据中包括低于110°C 的温度 (在加热和冷却过程中), 应进行论证。
【解读】
这个规定实际约定了任何低于110°C的过程,无论其时间长短以及实际对灭菌的贡献,均不应该参与到无菌F0值的计算过程中去。
关于F0概念和微生物降低的信息见 Ph. Eur. 5.1.5 F0值在水溶性制剂蒸汽灭菌中的应用。
微生物负荷限度应与任何预灭菌工艺的微生物负荷降低能力 (如过滤) 一致。在没有特殊说的情况下,对于水溶液,表格1所述的限度对于活性物质和药物产品制剂是可以接受的。其他用来控制微生物负荷处于既定水平的测试方法和限度应进行论证。
F0值< 8分钟的湿热工艺可作为无菌处理后的终端热处理, 适用于无法承受完整的终端灭菌程序的制剂。此类工艺可进一步确保经无菌过滤(或以其他方式灭菌) 后进行无菌分装的大批量组分的SAL。无菌工艺后终端热处理也见表格1。
需要强调的是, 这种额外的无菌工艺后进行终端热处理的工艺不应用来作为不良无菌生产操作的补偿。这与没有额外无菌加工终端热处理在无菌工艺部分的要求是一样的。
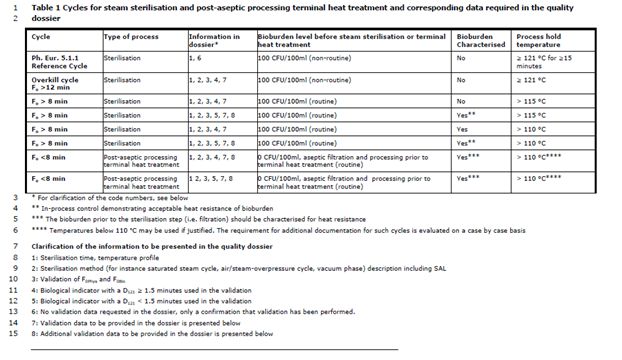
表格1 蒸汽灭菌循环和无菌后处理终端热处理工艺以及相关的质量文档数据要求
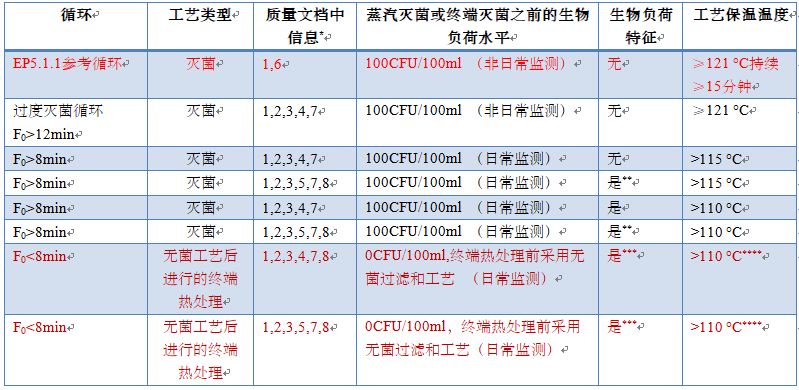
*代码含义参见以下的解释
**中控证明负载微生物的耐热性是可接受的
***除菌步骤(例如过滤)前的负载微生物应进行耐热性确认
****110C以下的温度需要进行合理化解释,这些情况下需要额外的补充资料。
质量文档中需要的文件信息:
1. 灭菌时间,过程温度档案
2. 灭菌方法(例如饱和蒸汽周期,空气/蒸汽过饱和压力循环,真空)描述,包括SAL
3. F0phys和F0iso验证
4. 验证中使用的生物指示剂(D121≥1.5分钟)
5. 验证中使用的生物指示剂(D121<1.5分钟)
6. 文档中不需要验证文档,只需要确认验证做了
7. 质量文档需要递交验证数据
8. 质量文档需要额外的验证数据支持
对于不符合 Ph. Eur. 标准工艺要求的所有蒸汽灭菌工艺, 需在质量档案中提供的验证数据 (表格1中所需信息 7):
腔体的装载布局和腔体中物品的装载布局图(包括加热最慢的位置); 性能确认总结。
至少三次灭菌程序运行的物理和生物效果确认总结, 显示SAL≤10-6, 如 ph. Eur第5.1.1章节的要求:
显示灭菌腔室中的灭菌装载达到了规定的循环参数, 包括时间、温度、压力和F0值 (如适用);
装载中温度探头之间温差可接受;
装载中可接受的 F0值波动;
物理和生物学验证之间的关系。
对于生物学验证, 应使用Ph.Eur. 5.1.2章节 “用于无菌产品生产的生物指示剂和相关微生物制品”中规定的D121℃值≥1.5分钟的生物指示剂。
The SAL should be determined, its microbiological basis should be justified and details of calculations provided in the quality dossier. Preferably it should be calculated from the maximum bioburden per container and the D-value of the biological indicator used in the validation.
应确定SAL,其微生物基础应合理,并在质量档案中提供计算细节。最好是根据每个容器的最大生物负荷和验证中使用的生物指示剂的D值来进行计算。
Additional validation data to be provided in the quality dossier for low energy steam processes or where a bio-indicator with a D121-value of <1.5 minutes is used in the validation of the sterilisation process (required information 8 in Table 1):
在低杀灭率蒸汽灭菌工艺的质量档案中提供的补充验证数据,或在灭菌过程的验证中使用D121值<1.5分钟的生物指示剂的情况下需提供的补充验证数据(表格1中所需信息 8):
The following additional data should be provided:
应提供以下补充数据:
A justification for the start point of the sterilisation phase, that is the temperature when the temperature sensors record the F0 from the start to end of the process;
论证灭菌段的起点,即灭菌开始至结束温度探头用于记录F0的温度;
Biological indicators with suitable resistance at the actual temperature range as described in Ph. Eur. 5.1.2 should be included in the validation to demonstrate sensitivity to the process.
验证应使用在 Ph.Eur.第5.1.2章中所述的实际温度范围内具有适当耐热性的生物指示剂,以证明对工艺的敏感性。
More detailed validation data is requested to ensure that the proposed sterilisation process is suitable for low temperature processes and for processes using biological indicators of low heat resistance because:
为了确保使用低温工艺和使用低耐热性生物指示剂的灭菌工艺是适当的,需要更详细的验证数据, 因为:
The change in lethal effect in relation to the process temperature may not be log linear at lower sterilisation temperatures.
在较低的灭菌温度下, 杀灭效果与工艺温度的关系可能不是呈对数线性的。
The SAL demonstrated in the validation of a sterilisation process is dependent on the heat resistance of the biological indicator used in the validation of the process. When a biological indicator of low D-value is used in the validation of the sterilisation process, the SAL demonstrated becomes numerically higher, but does not provide as high a safety margin as where a more resistant biological indicator is used. The SAL should always be established in relation to a D-value that is higher than that of the normal bioburden at routine production.
在灭菌工艺的验证中显示的SAL取决于在验证过程中使用的生物指示剂的耐热性。当在灭菌过程的验证中使用低D值的生物指示剂时, 所显示的SAL会变得更高,但不能提供与使用更耐热的生物指示剂那样高的安全系数。SAL应该基于比日常生产中正常生物负荷高的D值来建立。
【解读】
这个非常全面,没有更多需要解释的了,唯一要做的就是把它打印出来贴在自己办公室的墙上吧!对应的科学解释,后面两段话的解释也很具体了。如果还是看不懂的朋友,要去先学习下D值,SAL,F值,Z值这些基本概念了。
唯一需要提醒的是,在应用本指南的要求的时候,不能生搬硬套,实际工艺日常生产中的生物负荷,实际的可能的菌种信息,工厂都应该尽可能多的收集,然后基于这些实际的数据和实际的情况,来科学的选择适合自己的生物指示剂,来进行科学的这些灭菌工艺值的计算,然后合理的去解释给监管当局。整齐划一的试图用一个标准,一种方法,一种生物制试剂去解决自己多个产品多条生产线的所有问题,并不是好的“质量文化”和科学的质量态度,往往会后日后的运行管理带来潜在的不可预期的风险。

全部 0条评论