分享|偏差分类矩阵表
一、偏差管理问题
一般而言,偏差就是不符合已建立的标准。欧盟GMP指导原则写明任何偏离已批准需求和程序的偏差都必须记录并解释。 偏差的概念是如此之宽以致于偏差管理在用于制药行业时出现一些问题,比如
• 偏差有处理过度的趋势,因为“任何事都要报告”。 这个可能导致根本原因缺乏调查和实施的纠正预防措施缺乏有效性的分析。
• 所有偏差彻底处理可能耗尽可利用的资源意味着真正重要的问题没有正确处理。 从商业的角度讲最好遵照每个事件/偏差的重要性分派资源。
• 要评估每个偏差的关键性也会用尽有价值的资源。 如果工艺中的关键和关键产品质量属性没有提前确定,每个出现的新的偏差都意味着新的调查。
• 要量化开展的纠正预防措施和与公司其他部门交流存在困难。
二、使用风险管理处理偏差
ICHQ9(现在已经整合如EU GMP指导原则附录20中)建议在涉及到质量管理体系的生产工艺和过程中应用风险管理程序。偏差管理是后者的一部分可以在两个方面通过使用风险管理来优化:优先排序和决策。
• 优先排序: 风险管理工具用于遵照已确定的标准给不良事件分类。目的是根据存在对产品质量的风险调整偏差的处理。这个是初步“筛选”阶段允许简化对不相干事件的后续处理。
• 决策: 风险管理工具用于检查产品质量偏差的影响并证明纠正预防措施能保证。这个实际上对出现偏差的工艺的风险分析。用这种方法,事件不是孤立地评估,但其严重性和可能性已经事先确定。新的内容可以输入工艺风险评估表中并更新工艺风险评估并推进风险回顾。 使用风险管理处理偏差为基于文件化和科学记录的决策提供了一致的框架,同时也能够在药监机构面前决策时有自信的支持。 以下为风险事件给出两个实例用于使用风险管理工具对风险事件分类和处理偏差:
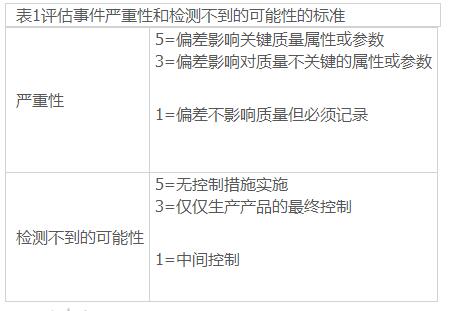
• 决定偏差关键性的流程图 • 失效模式和影响分析(FMEA),介绍没有检测出问题的可能性。 在ICHQ9描述的众多工具中,FMEA是一个适用并普遍用于相关行业的工具,例如医疗器械行业。 在此例中,假定工艺中出现的偏差已经经过适当的风险分析,所以以下信息是已知的:
• 失效(偏差)的历史及相关严重性评估标准
• 最经常发生失效(偏差)的可能性数据 • 工艺中的关键点和/或关键步骤
• 产品关键质量属性的定义 相同的方法在也在以下两个例子中使用:
• 分析阶段(依据不同情况使用的工具而不同)
• 分类阶段 • 处理阶段
三、使用流程图管理偏差 为了分类和定义事件(潜在偏差),可以建立如以下的系统。
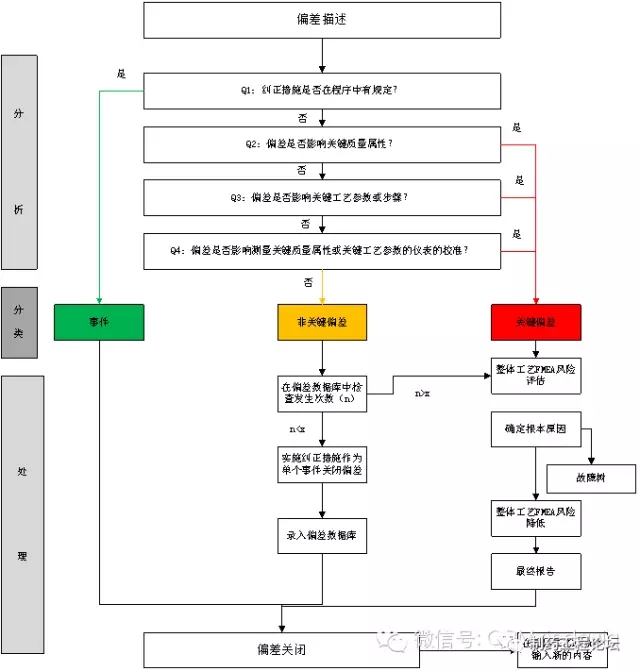
1、分析阶段 此阶段的目的是将发生的事件归类到已建立的分类中去。 这个可以基于设置带有是或否答案的一系列问题使用决策树来直接确定事件的分类。
Q1:纠正措施是否已在程序中被描述?
Q2:偏差是否影响关键质量属性?
Q3:偏差是否影响关键工艺参数或步骤?
Q4:偏差是否影响测量关键工艺参数或关键质量属性的仪表的校准?
2、分类阶段 按照这个策略,事件被归为以下类别的一种: • 事件(事件) • 非关键偏差 • 关键偏差
3、处理阶段 基于这里的分类,应按照以下方式制定措施: 事件: 如果事件被分类为一个事件,当需要解决事件的措施被描述时,偏差就关闭。 非关键偏差: 查询工艺偏差数据库看它已经发生了多少次。如果没有超过允许的特定的最大重复数量,事件就停留在“非关键偏差”分类。然后实施恰当的纠正措施并作为单独的时间关闭偏差。事件然后进入工艺偏差数据库、填入并更新为工艺生成的FMEA。 关键偏差: 事件放置入这个分类中: --当答案在决策树点中给出是一个“关键偏差”; –如果首先归类为“非关键”,但超过了允许重复的最大数量。 当关键偏差发生时,必须使用整体工艺风险分析的已建立的工具实施对产品质量影响的完整的评估。 值得注意的是其他工具,比如故障树,可以用来确定所有类型偏差的根原因。一旦原因已知,适当的纠正预防措施应落实到位,并重新计算风险等级。最后,编写最终报告关闭偏差。 此信息将在风险回顾时用来更新和反馈整体工艺风险分析。 图1举例说明了上面描述的事件管理方案。
使用流程图管理偏差的实例 事件描述 注射剂配剂室工作台被污染。已超过行动限。
主要特征
• B级配剂室
• 配制的产品经过使用过度杀灭的最终灭菌(没有事件)
• 产品微生物负荷批批都控制。
• 房间每周监测。
• 房间其他工作台都在控制限度内。
• 微生物已经经鉴定为金黄色葡萄球菌。
• 这是第一次监测到。 一旦有了事件的完整的描述,就要对其分析。 分析和分类阶段
Q1:纠正多事是否已经描述在程序中? 没有,措施没有在程序中描述。
Q2:偏差是否影响关键质量属性? 台面的污染不被认为是一个关键质量属性。
Q3:偏差是否影响关键工艺参数或步骤? 这个事件不被考虑影响关键步骤,因为工艺最终实施最终灭菌。 Q4:偏差是否影响测量关键工艺参数或质量属性的仪表的校准? 不影响校准。 在上述决策树中给出的答案与是第一次检测到污染的事实一起意味着这次事件被分类为非关键偏差。
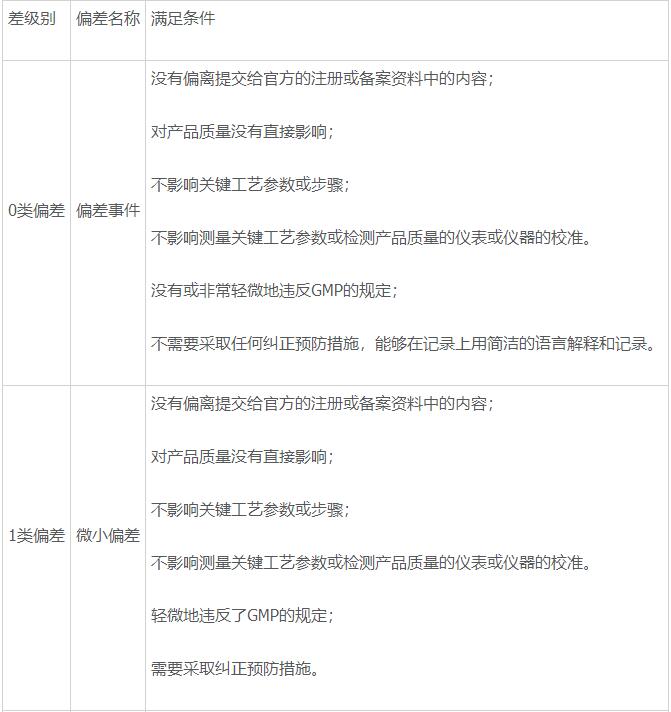
- 根据偏差对产品质量、法律法规及注册要求等影响的情况将偏差分为以下4类:
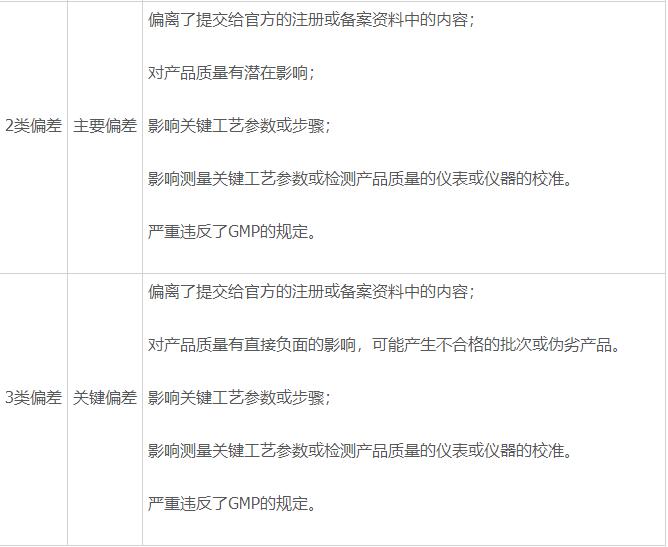
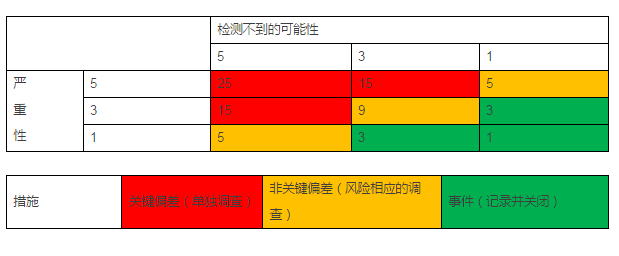
- 偏差分级的矩阵见下表:
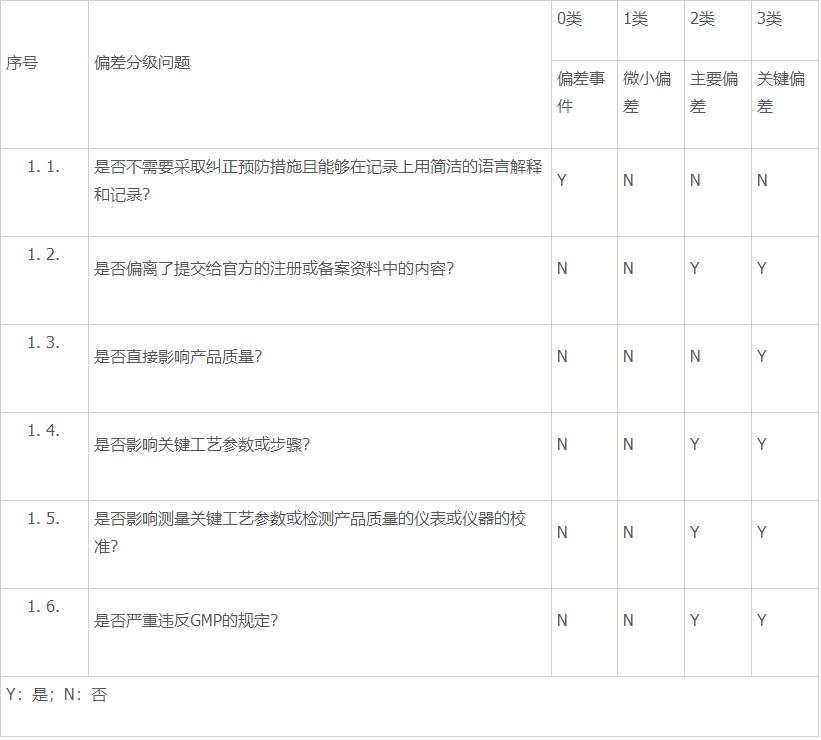
- 偏差等级的升级:当同一类型偏差发生次数累计大于5次或连续大于3次,该偏差应自动上升一个等级,如1类微小偏差累计发生次数大于5次或连续发生大于3次,则在偏差分级时应定为2类偏差。
- 来源: 制药工程论坛

全部 0条评论