分享|医疗器械产品注册申报的四大步骤详解
那么在注册申报方面有哪些需要注意的地方呢?
医疗干货三群邀请了深圳领先医疗服务有限公司的负责人,先健科技法规总监,10年高风险医疗器械法规和质量管理工作经验的医疗老师给大家介绍医疗器械注册与申报的那些事。
大家晚上好,很高兴有这个机会给大家介绍医疗器械产品的注册基础入门。大家对注册证并不陌生,那么注册证应该经过怎样的过程获得?其中有几个关键点就是
产品检测、临床试验以及体系考核
以及最后的
注册申报审批
这几个步骤。
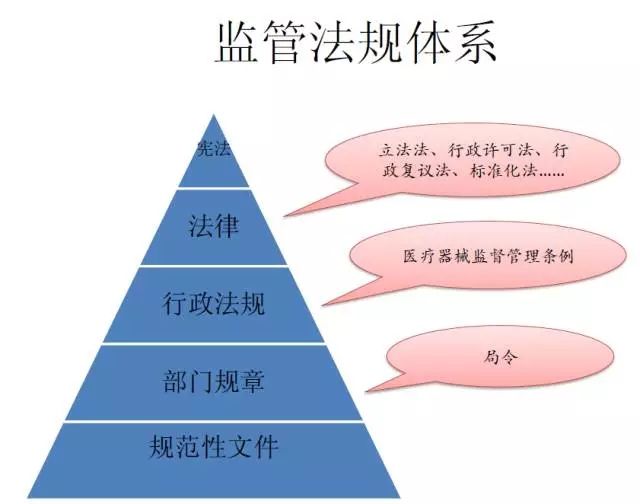
医疗器械做任何工作都是有法可依的。
大家都知道中国的最高法是宪法,医疗器械领域最高法是医疗器械的《监督管理条例》。不管从事医疗器械的研发、注册、临床、经营、生产等等都有相应的法律法规作出比较详细的规定。
接下来给大家讲一个比较感兴趣的话题:产品需要多少时间?需要经过怎样的流程才能拿到这个注册证?
首先器械的注册有不同的类别,我们国家分为三类:一类、二类、三类。一类产品只需要在药监局备案而不需要经过审批。二类和三类的产品需要经过注册审批过程。
现在主要介绍二类和三类产品的注册流程。


1
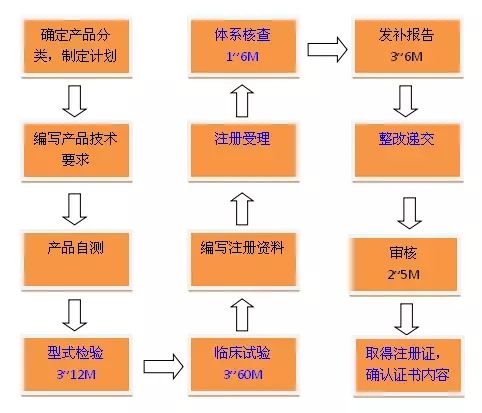
产品注册流程:确定分类、制定注册计划
第一步——检测
在产品基本定型以后进行产品技术要求编写,编写后内部再进行自测。内部自测达到技术要求规定以后(有的企业不具备自测能力,可以初步判断技术指标符合性,自行评估是否达到送检标准),送到第三方的检测机构进行注册检测。检测机构出具的检测报告就是后续启动临床试验和注册申报必须的报告,大多情况下市场招投标过程也会用到。
第二步——临床实验
注册检测后进行临床试验。与研究者共同确定临床试验方案后送到医院进行伦理审批。临床试验完成后将前期的注册检测报告、临床试验报告以及临床前的研究资料一起递交到药监局进行申报。
第三步——注册递交审批
药监局受理处收到注册文件以后会进行初步的审查,随后送到技术审核员手上进行技术审评工作。在此期间,需要在企业所在省药监局申请注册体系现场考核,考核结束以后拿到考核报告的同时会收到药监局第一轮的发补意见。这个过程大概需要2~5个月的时间。具体视产品类别难度和是否开展专家会。
第四步——对产品安全性问题进行整改
根据药监局提出的对产品安全有效性方面的问题进行针对性的整改,这需要在
一年时间内回复递交到药监局
,然后药监局用2~3个月时间对整改的内容进行审核。需要注意的是
目前国家药监局规定只能进行一次审核
,所以审核结果要么通过要么就不通过。若通过技术审核就继续下一轮行政审核,再需要2~3个月时间可以拿到注册证。
相
信现在大家对注册的流程已经有初步的了解。
接下来给大家拓展介绍几个详细过程包括:
检测、临床试验以及体系考核。 拓展介绍:检测、临床试验以及体系考核的详细过程
检测检测
包括检测项目、检测方法以及接收指标,不同的产品有不同的标准要求。比如说电气安全、电磁兼容、生物相容性、产品性能、包装、灭菌、货架寿命、运输要求等等。
临床试验
在检测机构完成对产品的注册检测后,企业就可以用检测报告递交开展临床试验。
值得注意的是,目前法规规定检测报告必须在一年内启动临床试验。
医疗器械的临床试验,特别是高风险器械往往占据整个开发成本的60%-80%,临床实验要经过严格的病人招募、长期的随访、数据管理及统计报告等,往往需要三到五年的时间才能完成临床试验。所以
临床试验的结果直接影响到产品是否能够得到审批、间接的所有投入是否能够取得回报。
哪些产品需要做临床试验呢?
一类产品不需要进行临床试验;不在免试验目录范围内的二类三类产品通常需要进行临床试验;若新产品与已上市的产品在安全有效性方面没有差异,即已上市产品的临床试验结果能代表申报产品的结果,那么也不需要进行临床试验,但这往往需要取得同类器械企业的授权生产、使用临床数据方可。
临床试验资料包括医生签署的合同,伦理批件,知情同意书,临床试验方案和临床试验报告,这些资料需要递交给药监局进行审核。

体系考核
在递交药监局进行审核时,就可以申请体系考核。体系考核一般会有三种结果:
体系:YY/T 0287 (等同ISO 13485)
风险管理:YY/T 0316 (等同 ISO 14971)
临床:YY/T 0297(等同 ISO 14155)
电气安全:GB9706 (等同IEC60601)
生物学:GB/T 16886系列(等同 ISO 10993系列)
包装:GB/T 19633(等同 ISO 11607)
EO灭菌:GB 18279(等同 ISO 11135)
洁净室:GB/T25915系列(ISO14644),
GB/T16292等心血管植入物(假体/支架/滤器):( ISO 25539系列)
导管类器械:YY0285系列(等同ISO10555系列)
动物源器械:YY/T 0771系列(等同 ISO 22442系列)
注册检测,检测方案(即产品的技术要求)制定完成以后,需要在取得资质认证的检测机构进行送检。检测机构对技术要求进行预评价,即产品检测项目、方法初步判断是否充分。 产品的技术要求非常重要。 不管是注册审批,还是后续招投标、上市后药监局的抽检都是法律文件。产品的技术要求定的太高或太低都有可能给企业带来不必要的麻烦。 为什么这么说呢?技术指标过高生产成本增加、后续变更困难、上市后抽样有可能无法保持稳定性而不合格。指标定的太低或不足,注册阶段审核员会要求补充,重做或增加检测项目从而影响注册周期,特别是长期的检测项目一定要把握好。载药器械: ISO 12417


一是直接通过检查;
二是整改后通过检查;
三是体系考核发现严重安全隐患不通过检查。
大多数情况是整改后复查,这需要在规定期限内完成,注册过程的体系考核需要在六个月内完成整改。
经过检测、试验以及体系考核后递交注册,然后经过一轮的整改答复,就可以拿到注册证了。注册证是产品能够上市销售的必备工具。
讲了这么多,大家应该对注册的流程和周期有个基本的概念。
所谓注册证就是经过相应的药监部门或者授权机构进行风险评估,允许产品进入相应的国家的一个证书。
不同国家的审批侧重点也不一样。
对于中国药监局优先考虑的是法规风险,其次才是临床风险。
什么叫法规风险,类似“检测报告一年内必须启动临床试验”就是法规要求,不满足就无法进行批准。临床风险顾名思义就是最终医生使用,患者接受可能产生的风险。
不管在哪个工作岗位上,不管从事的是研发、生产、法规、质量亦或临床,从事医疗健康工作,都需要怀着对生命、对法规的敬畏之心来完成岗位的使命。因为我们生产的产品,下一秒甚至可能决定病人的生与死。
3
注册人员需要具备的几个能力
严谨的逻辑思考能力
即对产品的安全有效性要有非常周密的逻辑的判断和推理能力。法规为何提出这样的要求,检测项目为何无法合格,临床统计方案设计是否合理,设计输入输出是否可追溯...在整个生命周期过程存在的风险是否得到有效的识别、解决,与临床受益比是否可接受,与同类产品是否与时俱进。
强大的沟通技巧和资源整合能力。
不管是公司内部跨部门的沟通、收集、规范资料,还是外部对政府机构、临床单位、同行、CRO的请教、解释、说服,察言观色,信息确认,都需要一定的技巧。
高度的政治敏感性和趋势嗅觉
注册人员作为公司的“耳目”需要高度的政治敏感性,提前嗅到药监局的法规趋势,做好战略部署。一流企业定标准,二流企业做品牌、三流企业卖技术、四流企业做产品。希望越来越多国产企业能标准法规制定的话语权,创新、领先的技术,少做3C产品,即China Cheap Copy.
快速的学习总结能力
注册人员对于产品的技术、检测、过程控制、临床评估等资料高效的汇总到一起,从而更直接、有力的说服对外沟通,加快审批起着非常积极的作用。
作者:施小立
深圳领先医疗服务有限公司。

全部 0条评论