医疗器械软件生存周期过程—软件配置管理
CMMI 对软件配置管理实践说明
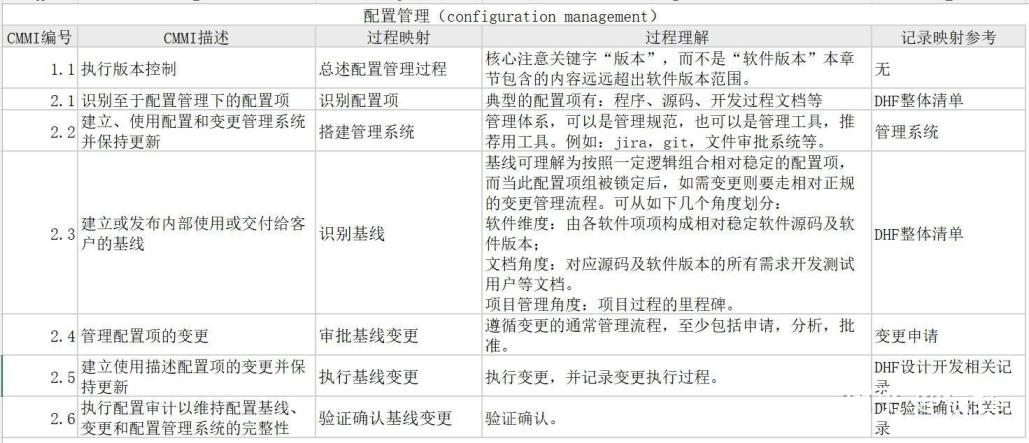
配置管理主要任务包括识别和记录配置项、控制配置项变更、记录变更状态、验证变更结果等。医疗器械软件建议采用清单+基线两大维度管理。清单可以简单理解为DHF,基线可以简单理解为变更管理。CMMI的配置管理(configuration management)实践域,即CM理解如下:
YY/T0664 软件配置管理要求
配置管理在YYT0664中的要求与CMMI的整体思想一致,但YY/T0664分为标识管理、变更管理、记录管理三块进行说明,所以更好理解。
8.1 标识管理
“8.1.1建立标识配置项的方法”理解为要建立作业指导书类的质量管理体系文件。“8.1.2标识未知来源软件”和“8.1.3标识系统配置文档”对配置项中容易疏忽的点提出明确要求。
8.2 变更管理
“8.2.1批准变更请求”、“8.2.2实施变更”、“8.2.3验证变更”从8.2.1到8.2.3把变更的3个关键环节要求都说清楚了。这3个关键的环节可以类比为产品立项、研发两大过程。8.2.1批准变更请求隐晦要求变更要执行申请、分析、结论批准3小步骤,可以类比为立项。接着流转到8.2.1到执行/实施变更、可类比为产品的研发过程。虽然研发过程中含有验证过程,为了防止验证过程被遗漏,所以强调一下验证过程,即引出了8.2.3验证变更,这样就形成了一个完整的变更闭环。
变更管理存在两种主流管理方式,上面介绍是其中一种,比较适合医疗器械软件管理。还有一种批准请求是指研发验证已完成,实施变更和验证变更是指导入生产环境。
8.3 配置状态报告
这里可以理解为产品研发过程中,各项任务是否完成的,目的是确保变更被完整执行且过程可追溯。

全部 0条评论